摘 要:静脉注射用免疫球蛋白(IVIG)在恶性血液肿瘤化疗、靶向治疗及造血干细胞移植中的应用越来越普遍,但国内外尚无儿童血液/肿瘤性疾病中IVIG应用的临床指南或共识。该共识基于儿童血液/肿瘤性疾病中IVIG应用的国内外研究进展而制定,对IVIG在儿童血液/肿瘤性疾病中的临床应用策略及其不良反应的防治提出具体建议。[中国当代儿科杂志,2021,23(4):319-327]
关键词:血液病 肿瘤性疾病 静脉注射用免疫球蛋白 专家共识 儿童
Pediatric expert consensus on the application of intravenous immunoglobulin in children with hematological/neoplastic diseases
Abstract:Intravenous immunoglobulin(IVIG) has been widely used in chemotherapy for hematological malignancies, targeted therapy, and hematopoietic stem cell transplantation; however, there are still no available guidelines or consensus statements on the application of IVIG in pediatric hematological/neoplastic diseases at present in China and overseas. This consensus is developed based on the research advances in the application of IVIG in pediatric hematological/neoplastic diseases across the world and provides detailed recommendations for the clinical application of IVIG in pediatric hematological/neoplastic diseases and the prevention and treatment of related adverse reactions.[Chin J Contemp Pediatr, 2021, 23(4): 319-327]
Keyword:Hematological disease; Neoplastic disease; Intravenous immunoglobulin; Expert consensus; Child;
免疫球蛋白是一种高度同源、与抗体分子类似的球蛋白,能在不同疾病及生理情况下影响免疫力。1952年,人免疫球蛋白G(immunoglobulin G,Ig G)首次用于治疗遗传性免疫球蛋白缺乏症;1981年,由健康供血者血浆制备的静脉注射用免疫球蛋白(intravenous immunoglobulin,IVIG)首次用于治疗自身免疫性疾病[1]。目前,美国食品药品监督管理局已批准IVIG的临床适应证有8大类,约占IVIG临床实际使用的一半左右。尽管IVIG在恶性血液肿瘤化疗、靶向治疗及造血干细胞移植中的应用越来越普遍,但国内外尚无儿童血液/肿瘤性疾病中IVIG应用的临床指南或共识。为了提高临床医师对IVIG的认识,提供规范的临床实践指导,广东省医师协会儿科医师分会和《中国当代儿科杂志》编辑部利用现有的循证医学证据,在征求国内专家意见的基础上,达成了IVIG在儿童血液/肿瘤性疾病中应用的儿科专家共识。
本共识的制定主要基于目前国内外关于儿童血液/肿瘤性疾病中IVIG应用的研究进展和相关研究数据,同时参考国外血液/肿瘤性疾病的治疗指南。在制定本共识的过程中遵循以下原则:(1)多学科(儿童血液、儿童肿瘤、新生儿、临床药学和统计学等学科)专业人员参与;(2)主要参考近20年公开发表的中英文文献(截至2020年6月)和处方资料;(3)根据文献或资料的可信等级(评判标准见表1),确定某一临床问题在本共识中的推荐等级(等级标准见表2)。
表1 证据水平的评价标准[2]

表2 推荐级别标准[2]

1 IVIG的作用机制
IVIG的作用机制还未完全清晰,目前提出的关于IVIG作用机制都属于直接抗体作用或免疫调节的2个主要类别[3],包括:(1)封闭单核巨噬细胞Fc受体,阻断自身抗体与Fc结合,使外周血细胞免遭自身免疫性破坏;(2)加速清除和中和循环中的自身抗体:IVIG的提取来自于大量(3 000~10 000名)健康人混合血浆,因而具有广谱抗正常人蛋白和抗独特性抗体的作用;免疫球蛋白的Fc与B细胞FcγR结合,可抑制B细胞的克隆增生;大剂量IVIG加速Ig G的分解代谢,清除致病性Ig G;(3)调节细胞因子独特型网络:免疫球蛋白的Fab含有多种抗炎症性和免疫调节性高亲和力抗体,能特异性结合白细胞介素(IL)1α、IL-2、IL-6、肿瘤坏死因子α(TNF-α)和干扰素γ(IFN-γ),从而阻止细胞因子与相应受体结合,抑制细胞因子的生物学活性,抑制免疫细胞的增殖、成熟、活性,甚至诱导凋亡;(4)补体抑制:Ig G可与激活的C3b和C4b补体形成共价结合,干扰免疫复合物的形成和对靶细胞膜的溶解破坏,阻断补体复合物与巨噬细胞相结合,抑制巨噬细胞对自身组织的损伤;(5)IVIG中的抗Fas抗体可阻断Fas配体介导的细胞凋亡,抑制过度炎症反应对自身组织的损伤;(6)清除细菌毒素和病毒:IVIG中含有多种抗细菌毒素抗体,对细菌毒素含有的超抗原具有中和作用,可清除体内持续存在的病毒与细菌毒素。
2 临床应用
根据IVIG的作用机制,其在儿童血液/肿瘤性疾病中的临床应用可分为免疫调节及抗炎、免疫替代、抗感染等三大部分。
2.1 免疫调节及抗炎
1980年偶然观察到大剂量IVIG在治疗川崎病和免疫性血小板减少症(immune thrombocytopenia,ITP)的确切疗效[4],从而发现了大剂量IVIG的抗炎和免疫调节作用,随后迅速广泛地应用到各种自身免疫性和炎症性疾病。
2.1.1 ITP
ITP是一种获得性自身免疫性出血性疾病,儿童发病率为4/10万~5/10万,其特征在于自身抗体介导的血小板破坏和巨核细胞产板不足导致血小板计数低,其一线治疗是全身性糖皮质激素和IVIG[5-6]。ITP是第一个使用IVIG治疗的自身免疫性疾病,疗效同类固醇激素[7]。在活动性出血情况下,IVIG可诱导血小板计数快速回升,迅速止血,1~3 d开始反应,高峰持续2~7 d[8]。不同中心采用的IVIG剂量和疗程不同。一项Meta分析显示,低剂量IVIG(总量<2 g/kg)对比大剂量IVIG(总量>2 g/kg),在临床疗效及发展成慢性ITP等方面无显著差异,且低剂量IVIG不良反应小及花费少[9]。美国血液学会指南小组建议单剂量IVIG 0.8~1 g/kg或短程糖皮质激素作为ITP的一线治疗,但为了迅速提升血小板水平,两者可联用[10]。参照国际共识[5],对需要治疗的急性ITP儿童患者,推荐一线治疗为单剂量IVIG0.8~1.0 g/kg,或常规剂量0.4 g/(kg·d)×3~5 d,必要时可重复给药;对于出血患儿紧急治疗,推荐糖皮质激素联合IVIG 1 g/(kg·d)×2 d[11-12](推荐级别:IA)。
2.1.2 自身免疫性溶血性贫血
自身免疫性溶血性贫血(autoimmune hemolytic anemia,AIHA)是由于机体免疫功能紊乱、产生自身抗体、导致红细胞破坏加速(溶血)超过骨髓代偿时发生的贫血,一般分为继发性和原发性,也可依据自身抗体与红细胞结合所需的最适温度分为温抗体型、冷抗体型及阵发性冷性血红蛋白尿症。Ig G介导的温抗体型最常见,一线治疗是糖皮质激素,7%~85%的患者有效,二线治疗推荐利妥昔单抗(rituximab,RTX)治疗和脾切除[13]。国内指南缺乏IVIG的推荐方案,治疗存在争议,不作为常规治疗[14]。早期研究显示AIHA临床起效所需的IVIG总量为5 g/kg[15]。荟萃研究显示54%的儿童患者对IVIG 0.4~0.5 g/(kg·d)×5 d治疗有反应,大部分患者病情可缓解3周以上,但有效率仍低于糖皮质激素和脾切除[16]。加拿大指南并不建议IVIG作为急、慢性溶血的常规治疗,但是指出可用于危及生命的溶血或其他治疗无效的溶血[14]。2011年英国指南推荐IVIG用于血红蛋白<60 g/L的短期治疗、脾切除术前的临时措施[17]。综上,推荐仅在严重或快速溶血时,给予大剂量甲泼尼龙联合单剂量IVIG 2 g/kg或者0.5 g/(kg·d)×4 d挽救治疗(推荐级别:ⅣB)。
2.1.3 噬血细胞综合征
噬血细胞综合征(hemophagocytic lymphohistiocytosis,HLH)是一类由原发性或继发性免疫异常导致的过度炎症反应综合征。IVIG可通过多种抗炎机制抑制巨噬细胞的活性和减轻组织损伤,故可作为HLH的辅助治疗,尤其是感染相关HLH病程早期,部分患者对IVIG单药或联合糖皮质激素反应良好[18-21]。一项比较儿童非家族性HLH对大剂量IVIG和HLH-2004方案临床反应的研究,结果显示二者疗效差异无统计学意义[21],且采用IVIG治疗可避免依托泊苷药物的不良反应[18-21]。因此,对常见感染诱发的HLH,推荐早期给予IVIG 1 g/(kg·d)×2 d联合地塞米松治疗;若病情无缓解,则采用HLH-1994方案(推荐级别:ⅣB)。
2.1.4 胎儿和新生儿溶血病
胎儿和新生儿溶血病(hemolytic disease of the fetus and newborn,HDFN)是由母体Ig G抗体胎盘转换导致胎儿和新生儿红细胞破坏所致,主要见于ABO、Rh D血型不合,本质上属于同种异体免疫性溶血性贫血,治疗主要包括光疗和换血。IVIG治疗HDFN的数据尚无定论[22],鉴于目前已有的临床试验数据和换血的风险,IVIG已被建议作为新生儿同种免疫性溶血性疾病的替代治疗,以减少换血的需要。推荐HDFN婴儿总胆红素水平在换血疗法阈值下20~30 g/L以内,或者尽管采用强化光疗后其胆红素水平仍在上升,可给予IVIG 0.5~1 g/kg持续2 h输注,必要时12 h后重复1次(推荐级别:ⅣB)。
2.1.5 输血后紫癜
输血后紫癜(post-transfusion purpura,PTP)是一种极为罕见的输血反应,主要发生于孕期或输血后对外源性血小板抗原致敏后的女性,最常见的抗原是血小板抗原PLA1(HPA1a)[23]。临床上主要表现为输血后5~10 d出现血小板持续减少,持续数日至数周,伴有瘀斑瘀点、活动性出血[24]。文献报道IVIG的有效率可高达90%,通常2 d内起效,平均治疗4 d后血小板计数回升至100×109/L[25-26]。推荐首选治疗是IVIG0.4 g/(kg·d)×5 d,重度血小板减少者按IVIG 1 g/(kg·d)×2 d(推荐级别:ⅣB)。
2.1.6 移植物抗宿主病
移植物抗宿主病(graft-versus-host disease,GVHD)是造血干细胞移植常见的并发症。美国食品药品监督管理局批准IVIG预防GVHD是基于Sullivan等[27]在1990年发表于《新英格兰医学杂志》的研究。在这项随机试验中,191名给予IVIG 0.5 g/kg(移植第-7天至第90天每周给予,然后每月直至第360天止),与191名未给予IVIG的患者进行了比较,多变量分析显示对照组急性GVHD>2级的风险增加。但后续研究显示,使用常规IVIG或巨细胞病毒(CMV)特异IVIG(CMV-IVIG)不会导致急性GVHD的风险降低或病死率降低[18]。2018年荟萃分析提出预防性使用IVIG对生存无显著影响,但对急性GVHD和CMV感染性疾病显示出积极的临床效果,对肝小静脉闭塞病和疾病复发则显示出负面效果[19]。基于上述证据,不推荐IVIG用于GVHD预防(推荐级别:IC)。
2.1.7 血栓性血小板减少性紫癜
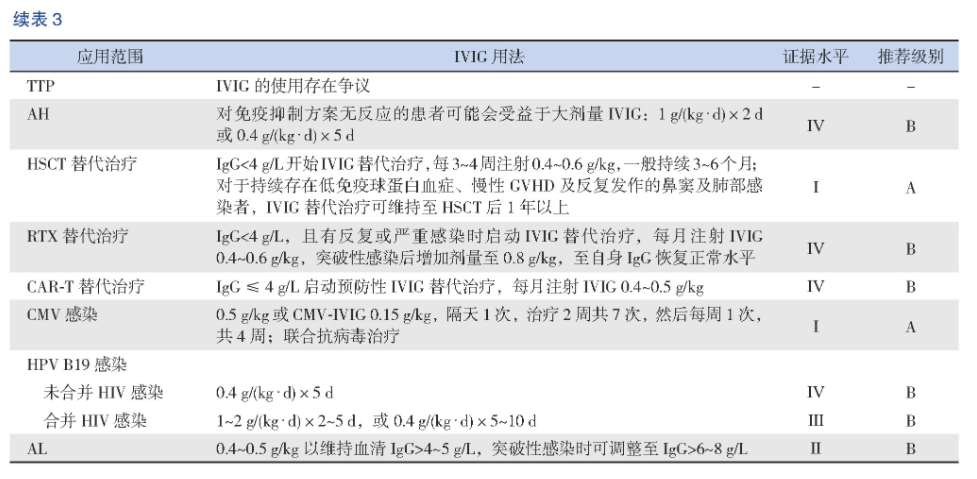
血栓性血小板减少性紫癜(thrombotic thrombocytopenic purpura,TTP)是一种罕见的微血管性凝血病,通常在感染或其他免疫系统损伤后出现,特别是在ADAMTS13突变的患者中,治疗可采用血浆置换、输注新鲜冷冻血浆等。IVIG的使用一直存在争议,不做常规推荐,但某些难治患者可能获益[11]。
2.1.8 获得性血友病
获得性血友病(acquired hemophilia,AH)是体内产生针对凝血因子Ⅷ(极少数是凝血因子Ⅸ)的特异性自身抗体而引起的凝血功能异常。AH有导致全身性出血的风险,治疗药物包括糖皮质激素、环磷酰胺、环孢素和RTX。国际指南建议使用糖皮质激素或糖皮质激素联合环磷酰胺作为一线治疗,RTX作为二线治疗[28]。对于免疫抑制方案无反应的患者,推荐给予IVIG 1 g/(kg·d)×2 d或0.4 g/(kg·d)×5 d[29-30](推荐级别:ⅣB)。
2.2 替代治疗
Ig G替代治疗能显著减少感染次数并降低感染严重性,现被广泛应用于各种继发性免疫缺陷状态,尤其是低丙种球蛋白血症患者[31]。低丙种球蛋白血症的定义是:血清Ig G水平低于同年龄健康对照者平均值2个标准差,或血清Ig G<0.6 g/L[32]。根据严重程度将低丙种球蛋白血症分为3类,即轻度:Ig G 0.4~0.599 g/L;中度:Ig G 0.2~0.399 g/L;重度:Ig G 0~0.199 g/L[33]。
2.2.1 造血干细胞移植
造血干细胞移植(hematopoietic stem cell transplantation,HSCT)术后代表体液免疫的B细胞恢复需要2年左右时间,在此期间受者可能存在严重获得性低丙种球蛋白血症(血清Ig G<4 g/L)[34]。因较多的临床研究及文献评价未发现IVIG常规替代治疗明显受益的证据,目前指南不支持HSCT术后常规应用IVIG[14,35]。但随着移植情况复杂化,单倍体和无关移植数量增多,强化的免疫抑制治疗,导致移植患者感染风险增加[36]。在欧洲,55%的移植中心在移植后使用IVIG预防感染[14]。数据显示,维持HSCT儿童血清Ig G水平>4 g/L至术后6个月,是一种预防病毒感染安全有效的方法[37]。推荐HSCT后患者每2周测定Ig G谷浓度,Ig G<4 g/L开始IVIG替代治疗,每3~4周注射0.4~0.6 g/kg,若输注剂量不足维持该谷浓度,每增加0.1 g/kg的IVIG大约提高谷浓度1.2 g/L,一般持续3~6个月;对于持续存在低免疫球蛋白血症、慢性GVHD及反复发作的鼻窦及肺部感染者,IVIG替代治疗可维持至HSCT后1年以上(推荐级别:IA)。
2.2.2 RTX治疗
RTX是一种抗CD20的单克隆抗体,常用于恶性血液肿瘤和自身免疫性疾病的治疗。RTX能特异性地与细胞膜抗原CD20结合,诱导B淋巴细胞耗竭的免疫反应,导致B细胞功能障碍、低丙种球蛋白血症。低丙种球蛋白血症主要发生RTX治疗后6个月以内,感染风险增加的因素有恶性肿瘤基础病、RTX疗程增加、Ig G水平低下超过6个月、联合吗替麦考酚酯和嘌呤类似物[38-39]。211例接受RTX治疗的B细胞淋巴瘤患者,38%出现低丙种球蛋白血症,6.6%的患者需要IVIG控制感染,其中79%患者在接受2个疗程以上RTX后开始IVIG治疗[33]。此外,有研究显示自身免疫性疾病中RTX耗竭B细胞,IVIG可促进未成熟和幼稚浆细胞从骨髓迁移至外周血和病变组织的微环境中,分化为产生正常或生理性抗体的CD138+浆细胞,同时扩增调节性T细胞和B细胞,在恢复免疫平衡中发挥关键作用[40]。针对接受RTX治疗后出现的中重度低丙种球蛋白血症患者(Ig G<4 g/L),推荐在发生反复或严重感染时启动IVIG替代治疗,每月注射IVIG 0.4~0.6 g/kg,突破性感染后增加剂量至0.8 g/kg,至自身Ig G恢复正常水平(推荐级别:ⅣB)。
2.2.3 CD19嵌合抗原受体T细胞治疗
针对B细胞CD19嵌合抗原受体T细胞(CAR-T)疗法是癌症免疫治疗的一个重要里程碑。CAR-T细胞输入体内,至少6个月无法检测到B细胞[41]。急性淋巴细胞白血病患儿接受CAR-T治疗后,43%的患儿出现了低丙种球蛋白血症,且治疗前患儿普遍处于免疫抑制状态,可能增加感染风险[42]。美国Memorial Sloan Kettering癌症中心对接受CD19靶向CAR-T细胞治疗的53例急性淋巴细胞白血病成人患者的感染并发症进行回顾性分析,发现治疗后28 d内感染发生率最高[43]。欧洲血液和骨髓移植学会及美国血液和骨髓移植学会建议,CAR-T治疗后的IVIG替代治疗遵循X连锁无丙种球蛋白血症原则[44]。因此,在CAR-T细胞输注后前3个月,每4周检测1次Ig G水平。推荐对Ig G≤4 g/L的患者启动预防性IVIG替代治疗,即每月注射IVIG 0.4~0.5 g/kg;对持续低丙种球蛋白血症(Ig G≤4 g/L)及严重、持续性或复发性细菌感染(尤其是鼻窦和肺部)的患者重启IVIG替代治疗,若Ig G 4~6 g/L但治疗后仍存在严重或反复感染,同样需要IVIG治疗[42](推荐级别:ⅣB)。
2.2.4 恶性血液肿瘤性疾病
目前尚无广泛系统研究IVIG用于预防儿童急性白血病和儿童恶性实体瘤相关感染或治疗的指南及推荐,亦不主张对急性髓系白血病或急性淋巴细胞白血病患者常规预防性使用IVIG。研究显示在接受化疗的急性白血病患儿中B细胞免疫功能受损是明确的,大部分急性B淋巴细胞白血病患儿接受强化诱导和维持化疗后,免疫球蛋白水平低下持续1年左右,而且功能性免疫缺陷在治疗结束后可能继续维持6~12个月[45]。对急性白血病患者进行个体化评估,参照慢性淋巴细胞性白血病治疗原则[46],推荐每月注射IVIG0.4~0.5 g/kg以维持血清Ig G>4~5 g/L,突破性感染时可调整至Ig G>6~8 g/L(推荐级别:ⅡB)。
2.3 抗感染
2.3.1 CMV感染
CMV感染是异基因HSCT术后严重的并发症之一,与急性和慢性GVHD的风险增加有关[47-48]。目前CMV感染的治疗措施包括免疫抑制剂减量、使用抗病毒药物和CMV特异性T细胞过继治疗等。既往系列病例报道证实大剂量IVIG或高滴度CMV-IVIG联合更昔洛韦治疗,可提高CMV肺炎的免疫缺陷患者生存率[49-50]。目前IVIG对CMV感染的治疗存在争议,2017欧洲白血病感染会议仅推荐IVIG用于治疗CMV肺炎[51]。遵循目前国际共识,针对CMV肺炎,推荐抗病毒药联合高滴度的CMV-IVIG 0.15 g/kg,隔天1次,治疗2周,共7次,然后每周1次,共4周;若无CMV-IVIG可用,推荐标准化的IVIG 0.5 g/kg,疗程同CMV-IVIG[50-52](推荐级别:ⅠA)。
2.3.2 细小病毒B19感染
细小病毒B19(human parvovirus B19,HPV B19)是一种常见的人类病原体,可感染类红细胞祖细胞并引起血液系统疾病,例如贫血和再生障碍性疾病。HPV B19的感染率为4%~72%,自体干细胞移植发生率最低,而恶性血液肿瘤病中感染率最高[53-54]。感染后最常见的表现是贫血、发热、传染性红斑、关节痛,HSCT术后因免疫缺陷可发生慢性感染的症状,如纯红细胞再生障碍性贫血[55]。目前没有针对HPV B19的抗病毒药物,由于体液免疫通过Ig G抗体的中和作用在预防和根除HPV B19感染中起着重要作用,因此IVIG被认为是这些免疫功能低下患者抵抗HPV B19感染的可行选择。在一项回顾性研究中,10名HPV B19感染所致的纯红细胞再生障碍性贫血的患者接受IVIG治疗,平均接受2.7个IVIG疗程,每个疗程平均剂量为(1.3±0.5)g/kg,平均80 d内9人贫血纠正,随访1年无复发[56]。根据已有的文献报道,对于未合并人类免疫缺陷病毒(HIV)感染的慢性感染患者,推荐免疫抑制剂减量和IVIG治疗,0.4 g/(kg·d)×5 d[57](推荐级别:ⅣB);对于合并HIV感染者,IVIG方案为1~2 g/(kg·d)×2~5 d,或0.4 g/(kg·d)×5~10 d(推荐级别:ⅡIB)。
2.4 IVIG在儿童血液/肿瘤性疾病中的应用汇总
综上所述,儿童血液/肿瘤性疾病由于疾病本身或治疗的因素,会出现继发性低丙种球蛋白血症、自身免疫功能异常、原发或继发性免疫功能低下等表现,因此IVIG在血液病的免疫调节和抗炎治疗及肿瘤的化疗、靶向治疗及HSCT后等的应用越来越普遍和重要。现将IVIG在儿童血液/肿瘤性疾病中主要应用汇总如下(表3)。
表3 IVIG在儿童血液/肿瘤性疾病中的应用
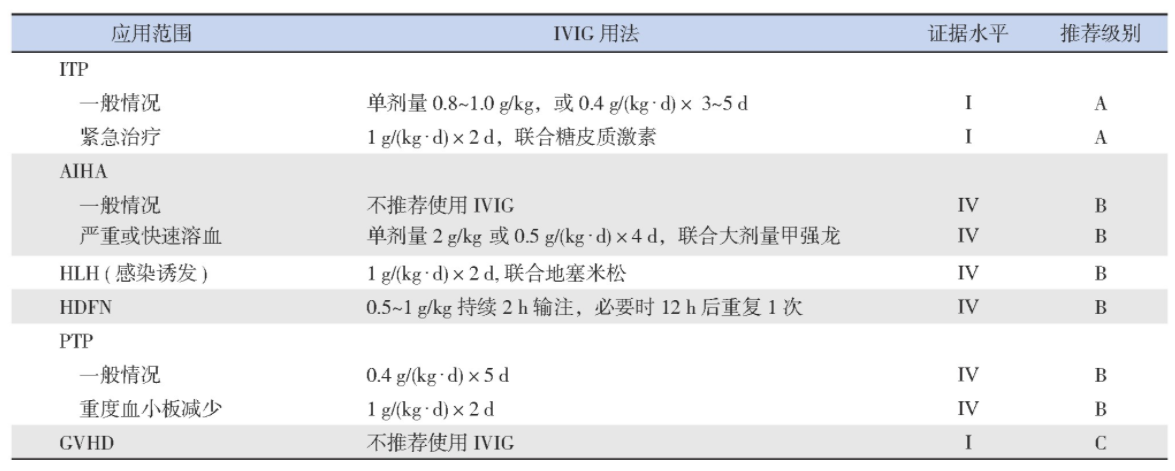
表3 IVIG在儿童血液/肿瘤性疾病中的应用
3 IVIG的不良反应
IVIG安全性较高,大多数与IVIG相关的不良反应是轻度和短暂的,总体不良反应发生率为5%~15%[58],严重的不良反应发生率为2%~6%[59]。不良反应的发生风险一般与IVIG剂量及输注速度有关,在Ig G亚类缺陷和高Ig M综合征中发生率也相对较高。推荐初始输注速率0.01 m L/(kg·min)[5%IVIG 30 mg/(kg·h)]维持15~30 min,然后增加至0.02 m L/(kg·min),若耐受性良好,可调整至0.04 m L/(kg·min),最后调整至最大速度0.08 m L/(kg·min)[60-61]。
常见的不良反应包括头痛、潮红、胸闷、发热、寒战、肌痛、疲劳、呼吸困难、背痛、恶心、呕吐、腹泻、血压变化、心动过速和过敏反应。其中头痛是很常见的不良反应,通常在输注过程中或输注后2~3 d内发生,轻者可予非甾体抗炎药止痛,严重者可用5-羟色胺受体激动剂(如舒马普坦)或糖皮质激素治疗或预防[62-63](推荐级别:ⅣB)。IVIG治疗后出现的一过性无症状中性粒细胞减少,通常在输注后2~4 d发生,2周内恢复,一般无需治疗,可通过糖皮质激素预防[64-65](推荐级别:ⅢB)。
严重的不良反应有严重过敏反应、急性肾衰竭、血栓栓塞事件和无菌性脑膜炎。全身性过敏反应的罕见病例通常见于Ig A缺乏患者,但Ig A缺乏者不是IVIG禁忌证[66]。对曾经发生严重过敏反应的患者,可检测抗Ig A抗体,若抗Ig A抗体滴度高(>1/1 000),Ig G替代治疗需谨慎应用[61](推荐级别:ⅣB)。肾功能损害首先表现为血尿素氮或肌酐升高,其次为少尿和肾功能衰竭,在大剂量输注后5~7 d达到高峰[67]。已有肾功能损害患者,应缓慢输注IVIG,适当水化,避免使用含蔗糖的IVIG产品,每日不超过0.5 g/kg的措施预防肾衰竭发生(推荐级别:ⅢB)。血栓事件估计发生率为1%~16.9%[68-69],危险因素包括首次大剂量使用IVIG、口服避孕药、高龄、既往/目前血栓形成、既往有动脉粥样硬化疾病、高黏滞综合征、遗传性高凝状态、输注速度快[70],可采用预水化、速度低于50 mg/(kg·h)、低渗IVIG产品(3%~6%)、预防性使用阿司匹林或低分子量肝素等措施降低高危患者的血栓发生率,已出现血栓并发症患者需接受抗血栓治疗(推荐级别:ⅢB)。
不同的IVIG制剂在浓度、稳定剂、钠离子浓度、渗透压、p H值等参数方面有所不同,在临床应用过程中需注意潜在风险,选择合适的IVIG产品进行治疗[61]:婴儿和限液患者需避免低浓度制剂;婴儿和心血管疾病患者应注意避免使用高钠含量的IVIG;含氨基酸的制剂在特定遗传代谢异常患者中需谨慎应用;使用麦芽糖或葡萄糖作为稳定剂的制剂不推荐用于糖尿病及肾损伤风险患者。
利益冲突声明:所有作者均声明不存在利益冲突。
参考文献
[1]Imbach P,Barandun S,Baumgartner C,et al.High-dose intravenous gammaglobulin therapy of refractory,in particular idiopathic thrombocytopenia in childhood[J].Helv Paediatr Acta,1981,36(1):81-86.
[2]CSCO肿瘤相关性贫血专家委员会.EPO治疗肿瘤相关性贫血中国专家共识(2010-2011版)[J].临床肿瘤学杂志,2010,15(10):925-936.
[3]Prins C,Gelfand EW,French LE.Intravenous immunoglobulin:properties,mode of action and practical use in dermatology[J].Acta Derm Venereol,2007,87(3):206-218.
[4]Imbach P,Barandun S,d'Apuzzo V,et al.High-dose intravenous gammaglobulin for idiopathic thrombocytopenic purpura in childhood[J].Lancet,1981,1(8232):1228-1231.
[5]Provan D,Arnold DM,Bussel JB,et al.Updated international consensus report on the investigation and management of primary immune thrombocytopenia[J].Blood Adv,2019,3(22):3780-3817.
[6]Provan D,Stasi R,Newland AC,et al.International consensus report on the investigation and management of primary immune thrombocytopenia[J].Blood,2010,115(2):168-186.
[7]Ekert H.Intravenous immunoglobulin versus oral corticosteroids in acute immune thrombocytopenic purpura in childhood[J].Lancet,1985,2(8467):1310.
[8]Rodeghiero F,Stasi R,Gernsheimer T,et al.Standardization of terminology,definitions and outcome criteria in immune thrombocytopenic purpura of adults and children:report from an international working group[J].Blood,2009,113(11):2386-2393.
[9]Qin YH,Zhou TB,Su LN,et al.The efficacy of different dose intravenous immunoglobulin in treating acute idiopathic thrombocytopenic purpura:a meta-analysis of 13 randomized controlled trials[J].Blood Coagul Fibrinolysis,2010,21(8):713-721.
[10]Neunert C,Lim W,Crowther M,et al.The American Society of Hematology 2011 evidence-based practice guideline for immune thrombocytopenia[J].Blood,2011,117(16):4190-4207.
[11]Benesch M,Kerbl R,Lackner H,et al.Low-dose versus highdose immunoglobulin for primary treatment of acute immune thrombocytopenic purpura in children:results of a prospective,randomized single-center trial[J].J Pediatr Hematol Oncol,2003,25(10):797-800.
[12]Alioglu B,Ercan S,Tapci AE,et al.A comparison of intravenous immunoglobulin (2 g/kg totally) and single doses of anti-Dimmunoglobulin at 50μg/kg,75μg/kg in newly diagnosed children with idiopathic thrombocytopenic purpura:Ankara hospital experience[J].Blood Coagul Fibrinolysis,2013,24(5):505-509.
[13]Zanella A,Barcellini W.Treatment of autoimmune hemolytic anemias[J].Haematologica,2014,99(10):1547-1554.
[14]Anderson D,Ali K,Blanchette V,et al.Guidelines on the use of intravenous immune globulin for hematologic conditions[J].Transfus Med Rev,2007,21(2 Suppl 1):S9-S56.
[15]Hilgartner MW,Bussel J.Use of intravenous gamma globulin for the treatment of autoimmune neutropenia of childhood and autoimmune hemolytic anemia[J].Am J Med,1987,83(4A):25-29.
[16]Flores G,Cunningham-Rundles C,Newland AC,et al.Efficacy of intravenous immunoglobulin in the treatment of autoimmune hemolytic anemia:results in 73 patients[J].Am J Hematol,1993,44(4):237-242.
[17]Davies JM,Lewis MP,Wimperis J,et al.Review of guidelines for the prevention and treatment of infection in patients with an absent or dysfunctional spleen:prepared on behalf of the British Committee for Standards in Haematology by a Working Party of the Haemato-Oncology Task Force[J].Br J Haematol,2011,155(3):308-317.
[18]Emmenegger U,Spaeth PJ,Neftel KA.Intravenous immunoglobulin for hemophagocytic lymphohistiocytosis?[J].JClin Oncol,2002,20(2):599-601.
[19]Freeman B,Rathore MH,Salman E,et al.Intravenously administered immune globulin for the treatment of infectionassociated hemophagocytic syndrome[J].J Pediatr,1993,123(3):479-481.
[20]Argyraki CK,Gabeta S,Zachou K,et al.Favourable outcome of life-threatening infectious-related haemophagocytic syndrome after combination treatment with corticosteroids and intravenous immunoglobulin infusions[J].Eur J Intern Med,2011,22(6):e155-e157.
[21]Rajajee S,Ashok I,Manwani N,et al.Profile of hemophagocytic lymphohistiocytosis;efficacy of intravenous immunoglobulin therapy[J].Indian J Pediatr,2014,81(12):1337-1341.
[22]Zwiers C,Scheffer-Rath ME,Lopriore E,et al.Immunoglobulin for alloimmune hemolytic disease in neonates[J].Cochrane Database Syst Rev,2018,3(3):CD003313.
[23]Ohto H,Yasuda H,Maeda H,et al.Post-transfusion thrombocytopenia in recipients with anti-HLA antibody[J].Transfus Sci,2000,23(3):271-273.
[24]Hawkins J,Aster RH,Curtis BR.Post-transfusion purpura:current perspectives[J].J Blood Med,2019,10:405-415.
[25]Mueller-Eckhardt C,Kiefel V.High-dose Ig G for posttransfusion purpura-revisited[J].Blut,1988,57(4):163-167.
[26]Becker T,Panzer S,Maas D,et al.High-dose intravenous immunoglobulin for post-transfusion purpura[J].Br J Haematol,1985,61(1):149-155.
[27]Sullivan KM,Kopecky KJ,Jocom J,et al.Immunomodulatory and antimicrobial efficacy of intravenous immunoglobulin in bone marrow transplantation[J].N Engl J Med,1990,323(11):705-712.
[28]Tiede A,Collins P,Knoebl P,et al.International recommendations on the diagnosis and treatment of acquired hemophilia A[J].Haematologica,2020,105(7):1791-1801.
[29]Sultan Y,Kazatchkine MD,Maisonneuve P,et al.Anti-idiotypic suppression of autoantibodies to factor VIII (antihaemophilic factor) by high-dose intravenous gammaglobulin[J].Lancet,1984,2(8406):765-768.
[30]Franchini M,Lippi G.Acquired factor VIII inhibitors[J].Blood,2008,112(2):250-255.
[31]Lucas M,Lee M,Lortan J,et al.Infection outcomes in patients with common variable immunodeficiency disorders:relationship to immunoglobulin therapy over 22 years[J].J Allergy Clin Immunol,2010,125(6):1354-1360.e4.
[32]Conley ME,Notarangelo LD,Etzioni A.Diagnostic criteria for primary immunodeficiencies.Representing PAGID (PanAmerican Group for Immunodeficiency) and ESID (European Society for Immunodeficiencies)[J].Clin Immunol,1999,93(3):190-197.
[33]Casulo C,Maragulia J,Zelenetz AD.Incidence of hypogammaglobulinemia in patients receiving rituximab and the use of intravenous immunoglobulin for recurrent infections[J].Clin Lymphoma Myeloma Leuk,2013,13(2):106-111.
[34]Storek J,Geddes M,Khan F,et al.Reconstitution of the immune system after hematopoietic stem cell transplantation in humans[J].Semin Immunopathol,2008,30(4):425-437.
[35]Center for International Blood and Marrow Transplant Research(CIBMTR),National Marrow Donor Program (NMDP),European Blood and Marrow Transplant Group (EBMT),et al.Guidelines for preventing infectious complications among hematopoietic cell transplant recipients:a global perspective[J].Bone Marrow Transplant,2009,44(8):453-558.
[36]Cowan J,Cameron DW,Knoll G,et al.Protocol for updating a systematic review of randomised controlled trials on the prophylactic use of intravenous immunoglobulin for patients undergoing haematopoietic stem cell transplantation[J].BMJOpen,2015,5(8):e008316.
[37]Foster JH,Cheng WS,Nguyen NY,et al.Immunoglobulin prophylaxis in pediatric hematopoietic stem cell transplant[J].Pediatr Blood Cancer,2018,65(12):e27348.
[38]Christou EAA,Giardino G,Worth A,et al.Risk factors predisposing to the development of hypogammaglobulinemia and infections post-Rituximab[J].Int Rev Immunol,2017,36(6):352-359.
[39]Makatsori M,Kiani-Alikhan S,Manson AL,et al.Hypogammaglobulinaemia after rituximab treatment-incidence and outcomes[J].QJM,2014,107(10):821-828.
[40]Ahmed AR,Kaveri S.Reversing autoimmunity combination of rituximab and intravenous immunoglobulin[J].Front Immunol,2018,9:1189.
[41]Porter DL,Levine BL,Kalos M,et al.Chimeric antigen receptor-modified T cells in chronic lymphoid leukemia[J].NEngl J Med,2011,365(8):725-733.
[42]Hill JA,Giralt S,Torgerson TR,et al.CAR-T-and a side order of Ig G,to go?-Immunoglobulin replacement in patients receiving CAR-T cell therapy[J].Blood Rev,2019,38:100596.
[43]Park JH,Romero FA,Taur Y,et al.Cytokine release syndrome grade as a predictive marker for infections in patients with relapsed or refractory B-cell acute lymphoblastic leukemia treated with chimeric antigen receptor T cells[J].Clin Infect Dis,2018,67(4):533-540.
[44]Kansagra AJ,Frey NV,Bar M,et al.Clinical utilization of chimeric antigen receptor T cells in B cell acute lymphoblastic leukemia:an expert opinion from the European Society for Blood and Marrow Transplantation and the American Society for Blood and Marrow Transplantation[J].Biol Blood Marrow Transplant,2019,25(3):e76-e85.
[45]van Tilburg CM,Bierings MB,Berbers GA,et al.Impact of treatment reduction for childhood acute lymphoblastic leukemia on serum immunoglobulins and antibodies against vaccinepreventable diseases[J].Pediatr Blood Cancer,2012,58(5):701-707.
[46]Oscier D,Dearden C,Eren E,et al.Guidelines on the diagnosis,i n v e s t i g a t i o n a n d m a n a g e m e n t o f c h r o n i c l y m p h o c y t i c leukaemia[J].Br J Haematol,2012,159(5):541-564.
[47]Cantoni N,Hirsch HH,Khanna N,et al.Evidence for a bidirectional relationship between cytomegalovirus replication and acute graft-versus-host disease[J].Biol Blood Marrow Transplant,2010,16(9):1309-1314.
[48]Chan ST,Logan AC.The clinical impact of cytomegalovirus infection following allogeneic hematopoietic cell transplantation:why the quest for meaningful prophylaxis still matters[J].Blood Rev,2017,31(3):173-183.
[49]Schmidt GM,Kovacs A,Zaia JA,et al.Ganciclovir/immunoglobulin combination therapy for the treatment of human cytomegalovirus-associated interstitial pneumonia in bone marrow allograft recipients[J].Transplantation,1988,46(6):905-907.
[50]Emanuel D,Cunningham I,Jules-Elysee K,et al.Cytomegalovirus pneumonia after bone marrow transplantation successfully treated with the combination of ganciclovir and high-dose intravenous immune globulin[J].Ann Intern Med,1988,109(10):777-782.
[51]Ljungman P,de la Camara R,Robin C,et al.Guidelines for the management of cytomegalovirus infection in patients with haematological malignancies and after stem cell transplantation from the 2017 European Conference on Infections in Leukaemia(ECIL 7)[J].Lancet Infect Dis,2019,19(8):e260-e272.
[52]Ljungman P,Cordonnier C,Einsele H,et al.Use of intravenous immune globulin in addition to antiviral therapy in the treatment of CMV gastrointestinal disease in allogeneic bone marrow transplant patients:a report from the European Group for Blood and Marrow Transplantation (EBMT).Infectious Diseases Working Party of the EBMT[J].Bone Marrow Transplant,1998,21(5):473-476.
[53]Jain A,Jain P,Kumar A,et al.Incidence and progression of parvovirus B19 infection and molecular changes in circulating B19V strains in children with haematological malignancy:a follow up study[J].Infect Genet Evol,2018,57:177-184.
[54]Atay D,Akcay A,Erbey F,et al.The impact of alternative donor types on viral infections in pediatric hematopoietic stem cell transplantation[J].Pediatr Transplant,2018,22(2):e13109.
[55]Karrasch M,Schmidt V,Hammer A,et al.Chronic persistent parvovirus B19 bone marrow infection resulting in transfusiondependent pure red cell aplasia in multiple myeloma after allogeneic haematopoietic stem cell transplantation and severe graft versus host disease[J].Hematology,2017,22(2):93-98.
[56]Crabol Y,Terrier B,Rozenberg F,et al.Intravenous immunoglobulin therapy for pure red cell aplasia related to human parvovirus B19 infection:a retrospective study of 10patients and review of the literature[J].Clin Infect Dis,2013,56(7):968-977.
[57]Eid AJ,Ardura MI;AST Infectious Diseases Community of Practice.Human parvovirus B19 in solid organ transplantation:guidelines from the American society of transplantation infectious diseases community of practice[J].Clin Transplant,2019,33(9):e13535.
[58]Stiehm ER.Adverse effects of human immunoglobulin therapy[J].Transfus Med Rev,2013,27(3):171-178.
[59]Perez EE,Orange JS,Bonilla F,et al.Update on the use of immunoglobulin in human disease:a review of evidence[J].JAllergy Clin Immunol,2017,139(3S):S1-S46.
[60]Berger M.Principles of and advances in immunoglobulin replacement therapy for primary immunodeficiency[J].Immunol Allergy Clin North Am,2008,28(2):413-437.
[61]Abolhassani H,Asgardoon MH,Rezaei N,et al.Different brands of intravenous immunoglobulin for primary immunodeficiencies:how to choose the best option for the patient?[J].Expert Rev Clin Immunol,2015,11(11):1229-1243.
[62]Cherin P,Marie I,Michallet M,et al.Management of adverse events in the treatment of patients with immunoglobulin therapy:a review of evidence[J].Autoimmun Rev,2016,15(1):71-81.
[63]Finkel AG,Howard JF Jr,Mann JD.Successful treatment of headache related to intravenous immunoglobulin with antimigraine medications[J].Headache,1998,38(4):317-321.
[64]Matsuda M,Hosoda W,Sekijima Y,et al.Neutropenia as a complication of high-dose intravenous immunoglobulin therapy in adult patients with neuroimmunologic disorders[J].Clin Neuropharmacol,2003,26(6):306-311.
[65]Khan S,DoréPC,Sewell WA.Intravenous immunoglobulininduced neutropenia[J].Pediatr Allergy Immunol,2010,21(5):892-893.
[66]Rachid R,Bonilla FA.The role of anti-Ig A antibodies in causing adverse reactions to gamma globulin infusion in immunodeficient patients:a comprehensive review of the literature[J].J Allergy Clin Immunol,2012,129(3):628-634.
[67]Eibl MM.History of immunoglobulin replacement[J].Immunol Allergy Clin North Am,2008,28(4):737-764.
[68]Daniel GW,Menis M,Sridhar G,et al.Immune globulins and thrombotic adverse events as recorded in a large administrative database in 2008 through 2010[J].Transfusion,2012,52(10):2113-2121.
[69]Ramírez E,Romero-Garrido JA,López-Granados E,et al.Symptomatic thromboembolic events in patients treated with intravenous-immunoglobulins:results from a retrospective cohort study[J].Thromb Res,2014,133(6):1045-1051.
[70]Rajabally YA,Kearney DA.Thromboembolic complications of intravenous immunoglobulin therapy in patients with neuropathy:a two-year study[J].J Neurol Sci,2011,308(1-2):124-127.








